核心业务
core business
一、QSR820基本概念
QSR820,又称21CFR820,是美国食品药品监督局(FDA)根据关于医疗器械管理的最高法律性文件《联邦食品,药品和化妆品法案(Federal Food, Drug, and Cosmetic Act)》而制定的规范医疗器械企业质量体系要求的法规,因其位于美国联邦法规(Code of Federal Regulations)第21卷第820部分,故名。QSR820是美国(人用)医疗器械制造商以及拟将产品销往美国的外国(人用)医疗器械制造商必须遵守的质量管理体系法规。
二、QSR820实施范围
21CFR820.1规定,所有在美国和波多黎哥境内的,或者有产品出口到美国和波多黎哥境内的医疗器械企业必须按QSR820的要求建立质量体系。各企业可以根据实际情况,满足QSR中与自己活动相关的条款。
QSR820不适用于医疗器械零件生产商,但FDA鼓励这类企业以QSR820中适用的条款为指导。
QSR820不适用于人血和血制品生产商。这类企业应遵循21CFR606的规定。
三、QSR820监管机构
FDA下属的CDRH(器械与放射健康中心)是专职负责医疗器械企业管理的政府机构,其根据FDA的授权安排检查员到各企业进行工厂检查。对美国境内企业一般每两年检查一次,境外企业不定期检查(自第一次审查开始,每次间隔不超过两年半)。所有检查费用由FDA承担。
在欧洲和美国本土,FDA也授权TUV等第三方机构进行工厂检查,但企业要支付相应的费用。
无论谁来检查,都只是一个符合性的检查,不颁发任何证书,不属于认证活动。
四、QSR820的主要内容
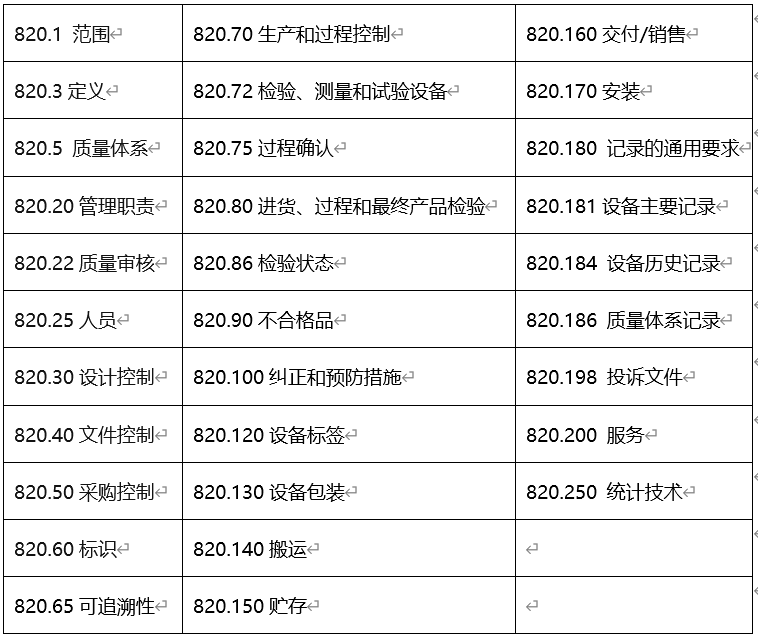
五、QSR820审核结果
1.NAI(No Action Indicated),没有进一步措施;表明现场审核没有发现缺陷或者只有非常轻微的缺陷,也叫“零缺陷”;
2.VAI(Volunteer Action Indicated),自愿整改措施;表明检查过程中发现不严重的缺陷;
3.OAI(Official Action Indicated),官方措施;检查过程中发现严重的缺陷,FDA必须采取措施以确保制造商能够符合法规的要求。